Stephen F. Shaban, M.D.
Перевод выполнен врачом гинекологом-эндокринологом Центра иммунологии и репродукции Татьяной Анатольевной Охтырской
Введение
Обзор мужского бесплодия
Около 15% супружеских пар при попытке забеременеть в первый же раз терпят неудачу. Большинство врачей ставит диагноз первичного бесплодия в случаях, когда беременность не наступает в течение одного года регулярной половой жизни без контрацепции. По статистике у 80-85% супружеских пар зачатие происходит в течение 12 месяцев половой жизни без контрацепции, а ситуации, когда беременность за этот период времени не наступила, расцениваются, как возможное женское или мужское бесплодие, и пациентам рекомендуется обследование. Данные, полученные за последние 20 лет, показывают, что приблизительно в 30% случаев возникновения проблем с зачатием играет роль только мужской фактор бесплодия и примерно в 20% нарушения обнаруживаются как у мужа, так и у жены. Таким образом, мужской фактор бесплодия, играет роль в 50% случаев.
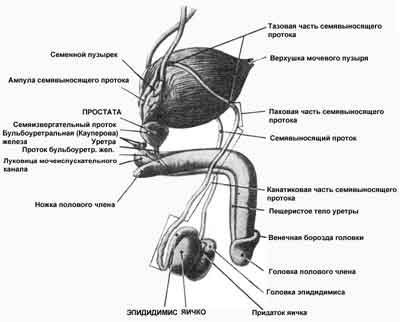
Рис. 1. Половые органы мужчины (По Кишш—Сентаготаи. Анатомический атлас человеческого тела)
Важнейшие проблемы выявления мужского фактора бесплодия касаются выбора времени начала обследования, наиболее эффективной схемы обследования мужчины и наиболее рациональных форм терапевтических и оперативных методов лечения. При решении проблемы бесплодия чрезвычайно важно рассматривать супружескую пару, как единое целое, чтобы обеспечить одновременное обследование и лечение обоих супругов. Было показано, что чем длительнее период бесплодия, тем ниже шансы супружеской пары на достижение положительного результата. Многие семьи начинают переживать уже после нескольких месяцев ненаступления беременности. В таких случях не стоит рекомендовать продолжать ожидать наступления беременности без обследования мужа. Начальные этапы обследования мужчины должны проводиться всякий раз, когда пациенты обращаются с основной жалобой на бесплодие. Такое обследование должно быть быстрым, неинвазивным и недорогим. Любопытно, что в почти 50% случаев успешного лечения бесплодия, когда обследованию и лечению подвергалась только жена, в спермограмме мужа обнаруживались нарушения, которые можно было расценивать как умеренно тяжелые, влияющие на мужское бесплодие.
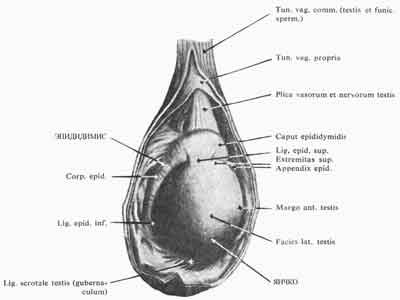
Рис. 2. Яичко и эпидидимис (По Кишш—Сентаготаи. Анатомический атлас человеческого тела)
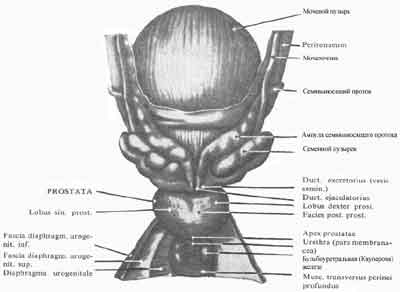
Рис. 3. Предстательная железа, семенные пузырьки и семявыносящие протоки. Вид сзади. (По Кишш—Сентаготаи. Анатомический атлас человеческого тела)
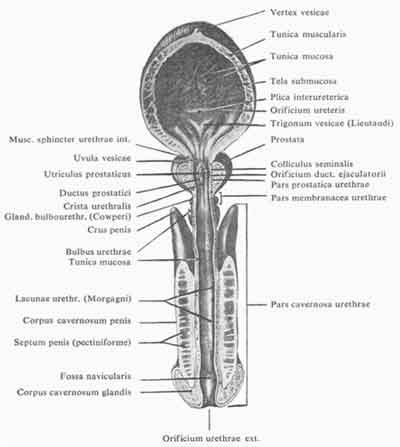
Рис. 4. Поперечный разрез мочевого пузыря и мочеиспускательного канала у мужчины. (По Кишш—Сентаготаи. Анатомический атлас человеческого тела)
Репродуктивная физиология мужчины. Ось гипоталамус-гипофиз-яички
Гипоталамус — главный интегративный центр функциональной репродуктивной системы у мужчин. Получая информацию от центральной нервной системы и яичек, гипоталамус регулирует образование и секрецию гонадотропин-рилизинг гормона (ГРГ). Нейротрансмиттеры и нейропетиды оказывают как ингибирующее, так и стимулирующее влияние на гипоталамус. Гонадотропин-рилизинг гормон (ГнРГ), секретируется гипоталамусом в пульсирующем режиме, что является необходимым звеном стимуляции синтеза и секреции обоих гонадотропинов гипофиза (ЛГ и ФСГ). Интересно и парадоксально, что назначение ГнРГ не в импульсном, а в постоянном режиме приводит после начальной стимуляции выброса гонадотропинов гипофиза к угнетению выделения ЛГ и ФСГ. И лютеинизирующий (ЛГ), и фолликулостимулирующий (ФСГ) гормон образуются в передней доле гипофиза и секретируются в импульсном режиме в ответ на пульсирующую продукцию ГнРГ. В яичках ЛГ и ФСГ связываются со специфическими рецепторами на клетках Лейдига и Сертоли. Тестостерон, главный продукт внутренней секреции яичка, является главным ингибитором секреции лютеинизирующего гормона гипофиза у мужчин. В периферических тканях тестостерон может превращаться в более мощный андроген дигидротестостерон или в мощный эстроген — эстрадиол. Образующиеся андрогены и эстрогены независимо друг от друга регулируют секрецию ЛГ.
Продукция ФСГ регулируется по механизму обратной связи ингибином, образующимся в клетках Сертоли. Ухудшение сперматогенеза сопровождается уменьшением образования ингибина и как следствие (по механизму отрицательной обратной связи) увеличением секреции ФСГ. Изолированное повышение уровня ФСГ — важный маркер состояния герминогенного эпителия яичек.
Секреция пролактина также имеет сложную взаимосвязь с гонадотропными гормонами гипофиза. У мужчин с гиперпролактинемией повышенный уровень пролактина оказывает ингибирующее влияние на секрецию ГнРГ. Помимо подавления секреции ЛГ и продукции тестостерона повышение уровня пролактина может оказывать прямое влияние на состояние центральной нервной системы. У мужчин с гиперпролактинемией, получающих заместительную терапию препаратами тестостерона, либидо и сексуальная функция не восстанавливались до тех пор, пока не происходило снижение уровня пролактина.
Яички. Клетки Лейдига
Тестостерон секретируется в пульсирующем режиме клетками Лейдига в ответ на пульсирующую секрецию ЛГ. Для тестостерона характерен суточный ритм секреции, с пиком секреции ранним утром и снижением после полудня или вечером. В интактном яичке после экзогенного введения препаратов ЛГ количество рецепторов к ЛГ в яичках уменьшается в результате даун-регуляции. Высокие дозы ГнРГ и его аналогов могут приводить к уменьшению числа ЛГ-рецепторов и таким образом подавлять секрецию ЛГ. На практике эта особенность используется с целью медикаментозной кастрации у мужчин с раком простаты. Эстрогены подавляют активность ряда ферментов, участвующих в синтезе тестостерона, и, таким образом, напрямую влияют на образование тестостерона. Также существует внутрияичковая ультракороткая обратная связь, посредством которой экзогенный тестостерон будет перекрывать действие ЛГ и подавлять продукцию эндогенного тестостерона. У здоровых мужчин только 2% циркулирующего в крови тестостерона находится в свободном или несвязанном состоянии; 44% тестостерона связано с тестостерон-эстрадиол-связывающим глобулином (сексстероидсвязывающий глобулин, SHBG), а 54% с альбуминами или другими белками. Эти стероид-связывающие белки модулируют действие андрогенов. SHBG обладает более высоким сродством к тестостерону, чем к эстрадиолу, и изменения в уровне SHBG приводят к изменению гормонального фона. Уровень SHBG увеличивается под влиянием эстрогенов, при лечении тиреоидными гормонами, циррозе печени и может снижаться под влиянием андрогенов, гормона роста, ожирения. Биологическое действие андрогенов проявляется на органах-мишенях, содержащих специфические белковые рецепторы к анадрогенам. Тестостерон из циркулирующей крови поступает в клетки-мишени, где под влиянием фермента 5-альфа-редуктазы превращается в более мощный андроген дигидротестостерон. Основные эффекты андрогенов в тканях-мишенях включают:
- регуляция секреции гонадотропинов гипоталамо-гипофизарной системой;
- инициация и поддержание сперматогенеза;
- дифференцировка внутренних и наружных половых органов в периоде внутриутробного развития;
- содействие половому созреванию в периоде полового созревания.
Семенные канальцы
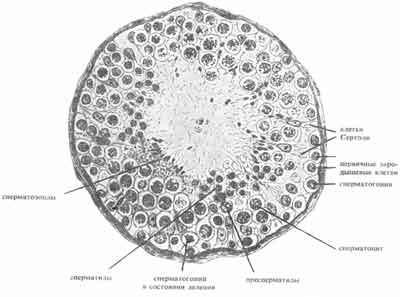
Рис. 5. Поперечный разрез канальца яичка (по Stieve)
Семенные канальцы содержат клетки герминогенного эпителия на разных стадиях созревания, а также поддерживающие их клетки Сертоли. Семенные канальцы составляют до 85-90% объема яичек. Клетки Сертоли представляют собой постоянную популяцию неделящихся клеток микроокружения. Они расположены на базальной мембране семенных канальцев и соединены между собой плотными соединениями (tight junctions). Эти плотные соединения вместе с тесно взаимосвязанными между собой мышечными клетками перитубулярного пространства формируют гемато-тестикулярный барьер. Функциональное значение гемато-тестикулярного барьера заключается в создании уникального микроокружения, необходимого для обеспечения сперматогенеза, и поддержании иммунологической привилегированности яичка. Такая изоляция очень важна, так как образование сперматозоидов происходит с периода полового созревания, что намного позже становления функции самораспознавания иммунной системы. Если бы образование сперматозоидов не было иммунологически защищено, то дифференцирующиеся клетки распознавались бы иммунной системой, как чужеродные, и уничтожались бы. Клетки Сертоли участвуют, как в обеспечении питания развивающихся клеток сперматогенеза, так и в фагоцитозе погибших клеток. Сперматогонии и молодые сперматоциты расположены в семенных канальцах ближе к базальной мембране и по мере созревания перемещаются в более верхние слои, вглубь просвета канальцев.
Герминальные, или сперматогенные, клетки располагаются в семенных канальцах строго определенным образом. Сперматогонии лежат непосредственно над базальной мембраной, а в в направлении просвета канальцев последовательно располагаются первичные сперматоциты, вторичные сперматоциты и сперматиды. Выделяют 13 различных типов клеток герминогенного эпителия, представляющие разные стадии созревания сперматозоидов.
Сперматогенез
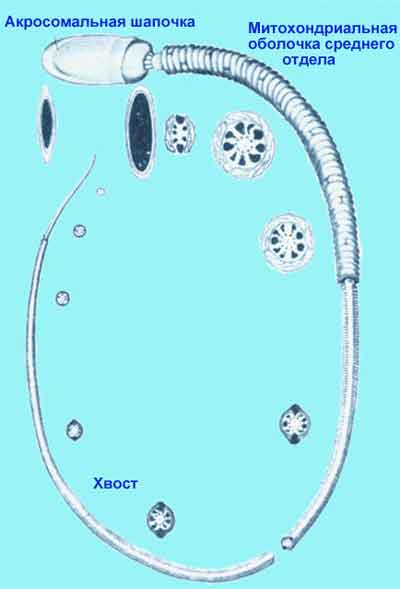
Рис. 6. Схема тонкого строения сперматозоида млекопитающих (по Bloom и Fawcett)
Сперматогенез — сложный процесс, при котором примитивные половые клетки, или сперматогонии, делятся, воспроизводя похожие на себя стволовые клетки, либо дают начало дочерним клеткам, в дальнейшем дифференцирующимся в сперматоциты. Дальнейшее деление сперматоцитов дает начало линиям клеток, в конечном итоге дифференцирующимся в сперматиды и далее в сперматозоиды. Дифференцировка включает в себя конденсацию ядра, формирование акросомы, утрату большей части цитоплазмы, формирование хвоста и перемещение митохондрий в среднюю часть сперматозоида, которая становится «машинным отделением» клетки, обеспечивающим работу хвостика. Группа клеток герминогенного эпителия, одновременно вступающая в процессы сперматогенеза, называется генерацией. Клетки одной генерации находятся на одной и той же стадии развития. Выделяют шесть стадий развития герминогенного эптелия. Развитие сперматозоида от первой стадии до шестой составляет один цикл. У человека продолжительность каждого цикла приблизительно 16 дней, а путь превращения от раннего сперматогония до зрелого сперматозоида занимает 4.6 цикла. Таким образом, продолжительность сперматогенеза у людей составляет около 74 дней.
Гормональная регуляция сперматогенеза
Между двумя отдельными частями яичка — семенными канальцами и окружающей их межуточной тканью — существует тесная структурная и функциональная связь. Лютеинизирующий гормон гипофиза влияет на сперматогенез, косвенным образом, стимулируя продукцию тестостерона. Клетки-мишени ФСГ — клетки Сертоли. Таким образом, тестостерон и ФСГ — гормоны, напрямую влияющие на эпителий семенных канальцев. Андроген-связывающий белок, образующийся клетками Сертоли и участвующий во внутриклеточном транспорте тестостерона, может играть роль резервуара тестостерона внутри семенных канальцев в дополнение к тестостерону, поступающему из яичек в канальцы эпидидимиса. Близкое взаимное расположение клеток Лейдига и семенных канальцев, а также образование клетками Сертоли андроген-связывающего глобулина, поддерживает высокую концентрацию тестостерона в микросреде дифференцирующихся клеток сперматогенеза. Гормональные изменения, необходимые для запуска сперматогенеза, происходят независимо от процесса поддержания сперматогенеза. Для поддержания сперматогенеза, например, при выключении гипофиза, необходим только тестостерон. Однако, если функция герминогенного эпителия выключилась в результате отсутствия тестостерона, то для повторного запуска сперматогенеза требуются как ФСГ, так и тестостерон.
Транспорт — созревание — хранение сперматозоидов
Хотя, образование сперматозоидов происходит в яичке, процессы созревания, хранения и транспорта сперматозоидов обеспечиваются придатком яичка (эпидидимисом). Сперматозоиды, находящиеся в семенных канальцах яичка, неподвижны и неспособны к оплодотворению. Их созревание завершается вне яичка в протоках придатка. Извитые семенные канальцы яичка заканчиваются сетью яичка, которое в свою очередь формирует выносящие канальцы (ductuli efferentes). По этим выносящим канальцам тестикулярная жидкость и сперматозоиды поступают из яичка в головку эпидидимиса. Придаток яичка илм эпидидимис имеет головку, тело и хвост и состоит из единственного, сильно извитого протока, длина которого составляет около 5-6 метров. Хотя, продолжительность транспорта по протоку эпидидимиса изменяется в зависимости от возраста и половой активности мужчины, в среднем это время составляет 4 дня. Именно в период созревания в головке и теле эпидидимиса сперматозоиды приобретают все увеличивающуюся подвижность и способность к оплодотворению яйцеклетки.
Помимо созревания сперматозоидов, придаток яичка выполняет роль «хранилища» или резервуара мужских половых клеток. Подсчитано, что внеяичковый резервуар спермы содержит около 440 млн. сперматозоидов, более 50% которых заключено в хвостовой части эпидидимиса. Из хвоста придатка яичка сперматозоиды поступают в семявыносящий проток (vas deferens), представляющий собой мышечную трубочку длиной 30-35см. Содержимое семявыносящего протока благодаря перистальтическим сокращениям стенки протока поступает в семявыбрасывающий канал (ductus ejaculatorius) и далее посредством эмиссии и эякуляции в уретру. Во время эмиссии секрет семенных пузырьков и простаты поступает в задний отдел уретры. Эякуляторные сокращения семявыбрасывающего протока и мышц шейки мочевого пузыря находятся под контролем симпатической нервной системы.
Во время эякуляции мышцы шейки мочевого пузыря сокращаются и наружный сфинктер расслабляется, а сперма продвигается по уретре благодаря ритмичным сокращениям перинеальных и бульбоуретральных мышц. Установлено, что первая порция эякулята включает небольшой объем жидкости из семявыносящего протока, но содержит большое количество сперматозоидов. Основной объем семенной жидкости образуется в семенных пузырьках и в меньшем количестве — в простате. Семенные пузырьки обеспечивают питательный субстрат спермы — фруктозу, а также простагландины и коагулирующие вещества. Общепризнанная функция семенной плазмы это создание буфера в кислой среде влагалища. Сгусток, сформированный спермой после эякуляции, разжижается в течение 20-30 минут под влиянием протеолитических ферментов простаты. Секрет простаты также добавляет в семенную жидкость ионы цинка, фосфолипиды, спермин, фосфатазу. Первая порция эякулята характеризуется максимальным содержанием сперматозоидов и секрета предстательной железы, в то время, как вторая порция представлена, прежде всего, секретом семенных пузырьков и содержит меньшее количество сперматозоидов.
Оплодотворение
Как правило, оплодотворение происходит в маточных трубах в период после овуляции. В периовуляторный период (в середине менструального цикла) происходят изменения цервикальной слизи — ее количество увеличивается, она становится более растяжимой и водянистой — ,создающие благоприятные условия для проникновения сперматозоидов в полость матки и защищающие сперматозоиды от высокой кислотности содержимого влагалища. Для осуществления оплодотворения внутри женского репродуктивного тракта сперматозоиды претерпевают физиологические изменения, известные как капацитация (capacitation). При взаимодействии с яйцеклеткой у сперматозоида возникает новый тип движения, называемый гиперактивной подвижностью. Одновременно сперматозоид претерпевает морфологические изменения, называемые акросомальной реакцией (acrosome reaction), заключающейся в освобождении литических ферментов и обнажении структур сперматозоида. В результате этих изменений сперматозоид становится способен добраться до яйцеклетки, пройти сквозь несколько слоев ее оболочки и войти внутрь ооплазмы.
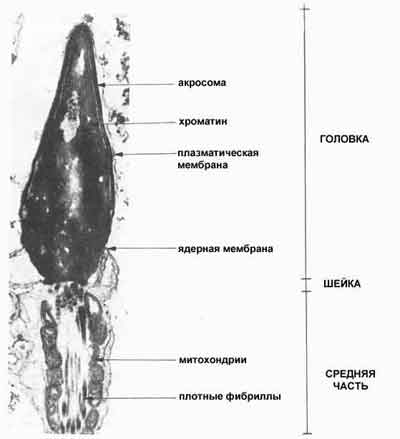
Рис. 7. Продольный разрез через головку и начало тела (средней части) сперматозоида (по Bisson)
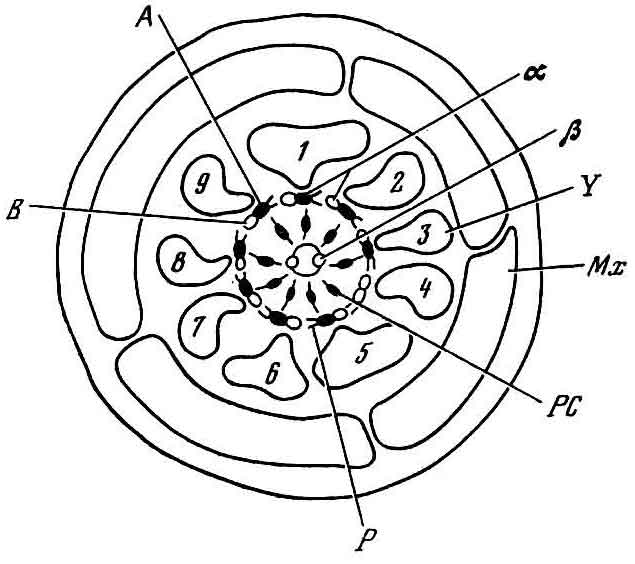
Рис. 8. Схематическое изображение поперечного среза жгутика сперматозоида. Видны девять пар периферических ?-фибрилл, состоящих из A и B-субфебрилл, две центральные ?-фибриллы и девять дополнительных внешних фибрилл, называемых третичными, или ?-фибриллами. Мх — митохондрии; Р — ручки; РС — радиальные связи (по Nelson)
Клиническое обследование. История заболевания
Основа обследования пациента с бесплодием — это тщательный сбор анамнеза и физикальное обследование. Необходимо выяснить, болел ли пациент такими специфическими детскими болезнями, как крипторхизм, постпубертатный орхит, обусловленный эпидемическим паротитом (свинкой), травма или перекрут яичек. Преждевременное половое созревание может указывать на адрено-генитальный синдром, в то время как задержка полового развития — на синдром Кляйнфельтера или идиопатический гипогонадизм. Необходимо уточнить не было ли влияния диэтилстильбистрола в периоде внутриутробного развития, т.к. это сопровождается увеличением частоты кист придатка яичка и крипторхизма. Должно проводиться подробное выяснение возможного влияния профессиональных факторов риска, негативных факторов окружающей среды, чрезмерного перегревания или облучения организма. Так, химиотерапия онкологических заболеваний обладает дозозависимым и потенциально разрушительным влиянием на герминогенный эпителий яичек. Необходимо уточнить, использовались ли препараты, потенциально влияющие на репродуктивный цикл у мужчин: анаболические стероиды, циметидин, спиронолактон. Сульфасалазин и нитрофурантоин могут влиять на подвижность сперматозоидов. Наркотики и чрезмерное употребление алкоголя связывают с уменьшением количества сперматозоидов и гормональными нарушениями. Иногда риск нарушений репродуктивной функции могут повышать предшествующие терапевтические и хирургические заболевания и их лечение. Ухудшение качества спермы наблюдается у мужчин с неопущением одного из яичек. Предшествующее оперативное лечение, операции на шейке мочевого пузыря или удаление ретроперитонеальных лимфатических узлов при раке яичек может стать причиной ретроградной эякуляции или отсутствия эмиссии. Также к ретроградной эякуляции, а в ряде случаев импотенции может приводить диабетическая нейропатия. При оперативном лечении грыжи паховой области возможно повреждение как семявыносящего протока, так и кровеносных сосудов яичек. У пациентов с фиброзом мочевого пузыря, как правило, отсутствует семявыносящий проток, семенные пузырьки, придаток яичка. К ухудшению сперматогенеза может приводить любое повышение температуры или общее заболевание. При этом нарушения в эякуляте обнаруживаются в течение 3-х месяцев после события, т.к. процесс сперматогенеза от начала до формирования зрелых сперматозоидов занимает около 74 дней. Помимо этого, различный промежуток времени необходим для транспорта сперматозоидов по канальцам. Иногда, важное значение имеют даже события, произошедшие в предыдущие 3-6 месяцев. Необходимо обратить внимание на сексуальные привычки человека, такие как регулярность половой жизни, частота эякуляции, использование специальных смазочных средств, а также представление пациента об особенностях овуляторного цикла. Обязательно выясняется, обследовался и лечился ли пациент ранее по поводу бесплодия; особенности репродуктивной функции в прошлых браках. Рецидивироующие инфекционные заболевания дыхательных путей и бесплодие у мужчин может быть связано с синдромом цилиарной дискинезии, при котором количество сперматозоидов остается нормальным, но сперматозоиды неподвижны по причине ультраструктурных дефектов. Синдром Картагенера — распространенный вариант синдрома цилиарной дискинезии характеризуется хроническими бронхоэктазами, синуситами, situs inversus и нарушением подвижности сперматозоидов. При синдроме Янга, также связанном с заболеваниями легких, ультраструктура ресничек не нарушена, но отток спермы из эпидидимиса затруднен вследствие сгущения спермы. При обследовании для этих пациентов характерна азооспермия. Утрата полового влечения, сопровождаемая головными болями, нарушением зрения и галактореей может указывать на опухоль гипофиза. Другие заболевания, приводящие к бесплодию, включают патологию щитовидной железы, эпилепсию, заболевания печени. Интересно, что сама по себе эпилепсия не является причиной бесплодия, но ее обычное лечение дилантином (фенитоин) влияет на репродуктивную функцию. Прием дилантина приводит к снижению секреции ФСГ. Хронические системные заболевания, такие как заболевания почек или серповидно-клеточная анемия сопровождаются нарушениями репродуктивного гормонального фона.
Физикальное обследование
Во время обследования особое внимание должно быть обращено на выявление признаков гипогонадизма. Как правило, при осмотре это обнаруживается как недоразвитие вторичных половых признаков, евнухоидное телосложение (размах рук на два вершка больше роста, отношение верхней части тела (от наивысшей точки до лобка) к нижней части тела (от лобка до пола) меньше 1; недостаточно выраженное оволосение по мужскому типу (подмышечное, лобковое, на лице и теле в сочетании с недостаточным ростом волос на висках)). Также необходимо обратить внимание на инфантилизм гениталий: небольшие размеры полового члена, яичек и простаты, слаборазвитую мошонку. У некоторых пациентов заметно недостаточное развитие мышечного развития и массы тела.
Важный этап обследования — тщательное обследование яичек. В норме размеры яичек в среднем составляют 4,5 см в длину и 2,5 см в ширину со средним объемом около 20 куб. см. Для определения размеров яичек можно воспользоваться орхидометром или линейкой. При повреждении семявыносящих протоков до периода половой зрелости яички имеют небольшие размеры и уплотнены;в то время, как при повреждении во взрослом возрасте размеры яичек уменьшены, но консистеция остается мягкой.
Характерный признак феминизации — гинекомастия. У мужчин с врожденным гипогонадизмом часто встречаются такие дефекты, как аносмия, нарушение цветовосприятия, мозжечковая атаксия, заячья губа, незаращение твердого неба. Гепатомегалия может сопровождаться нарушением метаболизма гормонов. Осмотр шеи помогает исключить увеличение щитовидной железы, сосудистые шумы или бугристость, связанные с заболеванием щитовидной железы. Неврологическое обследование обязательно включает определение полей зрения и рефлексов.
Отклонения от нормы придатков яичек могут быть следствием перенесенной инфекции и возможного нарушения проходимости придатков. При обследовании можно выявить уменьшение размеров простаты у мужчин с недостатком андрогенов или болезненность простаты при инфекционном процессе. Обязательно должны быть выявлены любые нарушения в строении полового члена: гипоспадия, искривление, фимоз. Содержимое мошонки необходимо тщательно пропальпировать у пациентов как в вертикальном, так и в горизонтальном положениях. Во многих случаях при простом осмотре варикоцеле не удается увидеть, но при обследовании в положении стоя, лмбо при проведении пробы Вальсальвы варикоцеле становится заметным. Варикоцеле часто становится причиной уменьшения размеров левого яичка, поэтому обнаружение разницы в размерах правого и левого яичка должно стать поводом к более внимательному поиску. Необходимо пропальпировать оба семявыносящих протока, так как примерно у 2% мужчин, обратившихся с проблемой бесплодия обнаруживается врожденное отсутствие протоков или семенных пузырьков
Претестикулярные причины мужского бесплодия
- Патология области гипоталамуса
- Изолированный дефицит гонадотропинов (синдром Кальмана)
- Изолированный дефицит лютеинизирующего гормона («фертильный евнух»)
- Изолированный дефицит ФСГ
- Врожденный гипогонадотропный синдром
- Патология гипофиза
- Гипофизарная недостаточность (опухоли, инфильтративные процессы, операции, облучение)
- Гиперпролактинемия
- Гемохроматоз
- Влияние экзогенных гормонов (избыток эстрогенов и андрогенов, избыток глюкокортикоидов, гипер- и гипотиреоз)
Патология гипоталамической области
Синдром Кальмана, проявляющийся изолированным дефицитом гонадотропинов (ЛГ и ФСГ), встречается как в виде спорадических мутаций, так и в семейной форме. И, хотя, встречаемость заболевания невелика (1 случай на 10000 мужчин), это вторая после синдрома Кляйнфельтера причина гипогонадизма. При синдроме Кальмана часто наблюдается аносмия, врожденная глухота, заячья губа, расщелина твердого неба, черепно-лицевая асимметрия, нарушение функции почек, цветовая слепота. Гипоталамический ГнРГ отсутствует. При стимуляции гипофиза экзогенным ГнРГ происходит выброс ЛГ и ФСГ. Помимо дефицита гонадотропинов (ЛГ и ФСГ) функция передней доли гипофиза не нарушена. Наследование аутосомно-рецессивное, либо аутосомно-доминантное с неполной пенетрантностью. Дифференциальный диагноз проводится с задержкой полового развития. Отличительная особенность синдрома Кальмана — размеры яичек менее 2 см в диаметре и характерный семейный анамнез в плане наличия аносмии.
Фертильный евнух «Fertile eunuch» патология, связанная с изолированной недостаточностью ЛГ гипофиза. Для пациентов характерно евнухоидное телосложение с различной степенью выраженности вирилизации и гинекомастии; крупные размеры яичек и снижение количества сперматозоидов в сперме. Содержание ФСГ в плазме крови в норме, в то время, как уровень и ЛГ, и тестостерона снижен. Причина заболевания в частичном дефиците гонадотропинов, при котором сохраняется адекватная стимуляция ЛГ синтеза тестостерона и происходит запуск сперматогенеза, но уровень тестостерона недостаточен для формирования вторичных мужских половых признаков.
Изолированная недостаточность ФСГ встречается редко. Типично нормальное развитие вторичных половых признаков по мужскому типу, нормальные размеры яичек и базальные уровни ЛГ и тестостерона. Сперма содержит от 0 до нескольких сперматозоидов. Уровень ФСГ в плазме крови низкий и не отвечает на стимуляцию ГнРГ.
Врожденный гипогонадотропный синдром характеризуется вторичным гипогонадизмом и множественными соматическими нарушениями. Синдром Прадера-Вилли проявляется гипогонадизмом, мышечной гипотонией у новорожденных, ожирением. Синдром Лоренса-Муна-Барде-Бидля наследуется по аутосомно-рецессивному типу и характеризуется олигофренией, пигментным ретинитом, полидактилией и гипогонадизмом. Оба синдрома связаны с нарушением выработки гипоталамусом ГнРГ.
Патология гипофиза
Гипофизарная недостаточность может быть следствием опухолей, кровоизлияний, носить ятрогенный характер вследствие оперативных вмешательств или облучения при инфильтративных процессах. Если нарушения функции гипофиза возникают до периода полового созревания, то основные клинические проявления — замедление роста, связанное с недостаточностью функции надпочечников и щитовидной железы. Гипогонадизм, встречающийся у взрослых мужчин, как правило, развивается вследствие опухоли гипофиза. Жалобы на импотенцию, снижение либидо, бесплодие могут возникать за несколько лет до появления симптомов роста опухоли (головные боли, нарушения зрения,снижение функции щитовидной железы, либо надпочечников). Если мужчина уже достиг нормальной половой зрелости, то, если заболевание не связано с недостаточностью надпочечников, требуется длительный промежуток времени для того, чтобы исчезли вторичные половые признаки. В конечном итоге яички станут мягкими и уменьшенными в размерах. Диагноз устанавливается на основании низкого уровня тестостерона в крови в сочетании со сниженными или находящимися на нижней границе нормы концентрациями гонадотропинов. В зависимости от выраженности снижения функции гипофиза в плазме крови будут снижены уровни кортикостероидов, тироксинсвязывающего глобулина и гормона роста.
Гиперпролактинемия может быть причиной как репродуктивных, так и сексуальных нарушений. Пролактин-секретирующие опухоли гипофиза, от микроаденомы (менее 10мм) до макроаденомы, могут приводить к уменьшению либидо, импотенции, галакторее, гинекомастии и прекращению сперматогенеза. Пациенты с макроаденомами обычно в первую очередь предъявялют жалобы на нарушение полей зрения и головные боли. В этой ситуации необходимо обследование, включающее компьютерную томографию или МР-сканирование области гипофиза, лабораторное определение гормонов передней доли гипофиза, щитовидной железы, надпочечников. У этих пациентов отмечается сниженный уровень тестостерона крови при снижении или тенденции к нижней границе нормы ЛГ и ФСГ, что отражает неадекватный ответ гипофиза на снижение продукции тестостерона.
Около 80% мужчин, больных гемохроматозом, имеют нарушение функции яичек. У этих пациентов гипогонадизм может развиваться вторично на фоне отложения железа в печени или может быть первичным, в результате отложения железа в ткани яичек. Отложения железа при гемохроматозе также обнаружены в гипофизе, делая гипофиз главным источником нарушений.
Что касается роли экзогенных гормонов, то опухоли надпочечников, клеток Сертоли, интерстициальных клеток яичек могут образовывать эстрогены. Цирроз печени сопровождается увеличением эндогенных эстрогенов. Прежде всего, эстрогены приводят к подавлению секреции гонадотропинов гипофизом и в результате развитию вторичной недостаточности яичка. Андрогены также могут подавлять секрецию гипофизом гонадотропинов и способствовать развитию вторичной недостаточности яичек. Использование некоторыми атлетами анаболических стероидов может приводить к временному бесплодию. Увеличение образования эндогенных андрогенов может возникать вследствие андроген-продуцирующей опухоли надпочечников, опухоли яичек, но наиболее частая причина — врожденная гиперплазия коры надпочечников. При ВГКН увеличено образование андрогенов корой надпочечников, что приводит к преждевременному половому созреванию и ненормально большим размерам полового члена. Так как секреция гонадотропинов подавлена, яички не созревают и имеют маленькие размеры. При отсутствии преждевременного полового созревания диагностика чрезвычайно трудна, так как избыточную вирилизацию сложно отличить от нормального сексуально зрелого мужчины. Необходимо проведение тщательного лабораторного обследования. В диагностически установленных случаях ВГКН лечение бесплодия проводится с использованием кортикостероидов. Зачастую врачи используют кортикостероиды в случаях идиопатического бесплодия. Однако, если в процессе обследования причина нарушений не установлена подобная терапия применяться не должна.
Иногда чрезмерное использование глюкокортикоидов при лечении неспецифического язвенного колита, бронхиальной астмы, ревматоидного артрита приводит к снижению сперматогенеза. Возможная причина вторичной дисфункции яичек — подавление секреции ЛГ повышенным уровнем кортизола плазмы. Коррекция избытка глюкокортикоидов сопровождается улучшением сперматогенеза.
Нарушение сперматогенеза возможно вследствие нарушения функции щитовидной железы. Гипер- и гипотиреоз могут влиять на сперматогенез. Гипетиреоз влияет как на работу гипофиза, так и на яички, изменяя секрецию рилизинг-гормонов и активизируя конверсию андрогенов в эстрогены в периферических тканях.
Тестикулярные причины мужского бесплодия
- Хромосомные нарушения
- (Синдром Кляйнфельтера, XX синдром (синдром сексуальной реверсии), XYY синдром)
- Синдром Нунан (мужской вариант синдрома Тернера)
- Миотоническая дистрофия
- Билатеральная анорхия (синдром отсутствия яичек)
- Синдром наличия только клеток Сертоли (аплазия герминогенного эпителия)
- Влияние гонадотоксинов (лекарства, радиация)
- Орхит
- Травма
- Системные заболевания
- (почечная недостаточность, заболевания печени, серповидно-клеточная анемия)
- Нарушения синтеза или эффекта андрогенов
- Крипторхизм
Варикоцеле
Ряд аномалий в структуре соматических хромосом связан с мужским бесплодием. При обследовании 1263 супружеских пар, обратившихся с проблемой бесплодия, у мужчин были найдены хромосомные нарушения в 6.2%. В подгруппе со сниженным количеством сперматозоидов менее 10 млн./мл процент встречаемости хромосомных нарушений у мужчин возрастал до 11%; а у мужчин с азооспермией частота хромосомных нарушений составила 21%. Однако, только в единичных случаях подтвердилась взаимосвязь бесплодия со специфическими хромосомными нарушениями, как D-D транслокация, кольцевые хромосомы, реципрокные транслокации и ряд других аберраций. Тем не менее, для исключения аномалий соматических и половых хромосом у мужчин с выраженной олигоспермией или азооспермией должно проводиться цитогенетическое обследование.
Синдром Кляйнфельтера — генетическое нарушение, связанное с присутствием у мужчин дополнительной Х-хромосомы. При этом преобладают две разновидности кариотипа: 47XXY (клас