А можно мне карие глазки?

Генная инженерия человека нам, простым обывателям, все еще кажется чем-то из области научной фантастики. Тем неожиданней было сообщение издания «The Telegraph», в котором говорилось, что Совет по этике в Великобритании разрешил генную инженерию человеческих эмбрионов. Понятно, что от рекомендаций Совета по этике до закона о генетических вмешательствах «дистанция огромного размера», однако первый шаг, похоже, сделан.
« The Telegraph» обратился за комментарием к профессору Карен Юнг, председателю рабочей группы по редактированию генома и воспроизводству человека. Госпожа профессор заявила, что в будущем в числе репродуктивных технологий может оказаться и внесение наследуемых изменений генома для обеспечения определенных характеристик детей. Сперва, разумеется, таким способом будут бороться с наследственными заболеваниями, но потом «если технология будет успешно развиваться, у нее есть потенциал стать альтернативной репродуктивной стратегией, доступной родителям для достижения более широкого круга целей».
На вопрос, можно ли использовать генетическое редактирование, чтобы дети были высокими, со светлыми волосами и голубыми глазами (ну, если вдруг именно такая внешность будет в моде), профессор Йонг добавила что и этого она тоже не исключает…
Но у нас возник не этический, а, если так можно выразиться, технический вопрос: неужели ученые уже в состоянии переделать нам геном и заменить голубые глаза на карие?
Что такое геном человека (для тех, кто прогулял уроки биологии)
Вся наша жизнь закодирована в молекулах ДНК – дезоксирибонуклеиновой кислоты. Удивительно, но все эти огромные молекулы состоят из комбинации всего лишь четырех основных элементов: азотистых оснований аденина, гуанина, тимина и цитозина (их обычно для краткости обозначают первыми буквами – A, G, T, C). Сложные последовательности этих элементов служат своеобразными матрицами, на которых синтезируются РНК – рибонуклеиновые кислоты. РНК — «рабочие лошадки» нашего организма, у каждой – своя специализация. Одни участвуют в синтезе белков, задавая верную последовательность элементов, другие поставляют аминокислоты к месту синтеза белков, третьи – «перекраивают» своих собратьев, катализируя реакции с участием РНК.
” Лично мне наш геном напоминает муравейник: с ДНК — муравьиной королевой, бесконечно откладывающей яйца, из которых появляются РНК–муравьи, среди которых есть солдаты, няньки, рабочие…
А в Википедии приводят такой пример: «ДНК нередко сравнивают с чертежами для изготовления белков. Развивая эту инженерно-производственную аналогию, можно сказать, что, если ДНК — это полный набор чертежей для изготовления белков, находящийся на хранении в сейфе директора завода, то матричная РНК — временная рабочая копия чертежа отдельной детали, выдаваемая в сборочный цех».
Выбирайте аналогию по своему вкусу!
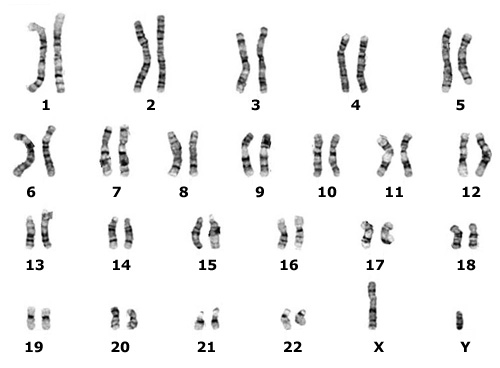 Молекулы ДНК есть в любой клетке нашего организма, в которой есть ядро. Молекулы – потому что знаменитые спирали ДНК «нарублены» на 46 различных по размеру «кусков», соединенных попарно – это 23 пары наших хромосом.
Молекулы ДНК есть в любой клетке нашего организма, в которой есть ядро. Молекулы – потому что знаменитые спирали ДНК «нарублены» на 46 различных по размеру «кусков», соединенных попарно – это 23 пары наших хромосом.
” В каждой паре хромосом одна досталась нам от отца, а другая от матери. 23-я пара отвечает за наш пол, поэтому хромосомы в ней могут отличаться: «ХХ» — у девочек, «ХУ» — у мальчиков.
Во всех аутосомах (не-половых хромосомах) и хромосома, доставшаяся от папы, и доставшаяся от мамы, содержат подобные гены на одних и тех же участках. Подобные – поскольку гены, у всех нас, вообще говоря, разные. К примеру, на участке, где располагается ген, ответственный за цвет волос, в одной хромосоме из пары окажется ген мамы-блондинки, а на другой – папы-брюнета. В таком случае один из генов будет доминировать, а второй, рецессивный, ждать своего часа. Если именно его передадут по наследству, и если в паре с ним окажется такой же рецессивный ген, то у него будет возможность проявить себя.
” Этот принцип наследования генетической информации чреват неприятными сюрпризами. И мы сейчас вовсе не о рождении голубоглазого блондина в семье кареглазых брюнетов, а о наследственных заболеваниях. Порой, скрытые в рецессивных генах, они дремлют во многих поколениях, никак не проявляя себя внешне. Но стоит такому гену встретиться со своим «собратом», и трагические последствия неизбежны.
Любые родители хотели бы вырезать зловредный ген из своей ДНК и заменить его на здоровый, обезопасив потомков. И тут мы снова возвращаемся к вопросу: неужели это реально?

В качестве эксперта мы привлекли кандидата биологических наук Светлану МИХАЙЛОВУ (pooha), научного сотрудника лаборатории молекулярной генетики человека Института цитологии и генетики СО РАН.
Генная инженерия и ЭКО
— Светлана Владимировна, генетический анализ во время проведения экстракорпорального оплодотворения, «зачатия в пробирке», вещь уже привычная?
— Да, оплодотворённой яйцеклетке дают несколько раз поделиться и анализируют, например, одну из 8 идентичных клеток. Этот метод используется в случаях, когда у пары высокая вероятность рождения ребёнка с генетическим нарушением, причина которого (конкретная генетическая перестройка или перестройки) известна. Если мутацию находят — клетки уничтожают, если нет – подсаживают по протоколу ЭКО женщине.
” — Доказано, что такое «отщипывание» клеток не приводит к нарушению развития зародыша. Этот метод технически гораздо сложнее и дороже, чем просто генетический анализ плода во время беременности, который проводится после забора амниотической жидкости или фрагмента плаценты, поэтому широкого распространения пока не получил.
— То есть, родителям остается только уповать, что однажды случайным образом «выпадет» комбинация здоровых генов. А нельзя ли как-то вырезать «плохие» гены?
— Ген удалять в большинстве случаев не надо, собственно, патогенные мутации как раз «удаляют» ген функционально. Надо заставить неправильно функционирующий ген работать нормально. Либо вырезать из него лишнее, либо вставить потерянное, либо заменить неправильное на правильное. Более простой подход — одним махом добавить в геном нормальную копию гена.
 Между прочим, технология «убрать плохую ДНК и вставить хорошую» уже реализована на практике! Правда, речь идет не о ядерной ДНК, о которой мы говорили до сих пор, а о митохондриальной. Вот что рассказывает об этом Светлана Михайлова.
Между прочим, технология «убрать плохую ДНК и вставить хорошую» уже реализована на практике! Правда, речь идет не о ядерной ДНК, о которой мы говорили до сих пор, а о митохондриальной. Вот что рассказывает об этом Светлана Михайлова.
Своя собственная ДНК есть у митохондрий – органелл, отвечающих за «энергоснабжение» клетки. В отличие от остальных хромосом, находящихся в ядре, митохондриальные ДНК — это небольшие кольцевые молекулы, их количество в клетке варьирует от десятков до тысяч копий и зависит от возраста.
Яйцеклетка богата митохондриями, а сперматозоид содержит всего одну, обеспечивающую движение его «хвостика». После оплодотворения эта митохондрия уничтожается, поэтому все митохондриальные гены человека достаются ему только от матери.
Если причина заболевания находится в митохондриальной ДНК, то возможно использование митохондрий «третьего родителя». При этом ядро яйцеклетки матери, имеющей патогенные мутации, пересаживают в цитоплазму яйцеклетки женщины с нормальными митохондриями, а потом оплодотворяют её сперматозоидами отца и подсаживают по протоколу ЭКО. В частности, метод цитоплазматической замены успешно использовался в случае материнского бесплодия, связанного с нарушениями в митохондриальной ДНК. С 2015 г. этот метод генетической «модификации» человека легализован в Великобритании, но по-прежнему запрещён в США. Законодательство Австралии готовится к новшествам относительно генной инженерии. Чтобы обойти существующие запреты, такие манипуляции проводят на территории стран, где нет соответствующего законодательства, например в Мексике и на Украине.
О том, как на свет появился первый новорожденный с ДНК трех человек, читайте в в нашей публикации «Родился первый ребенок от трех родителей».
Технологии изменения ДНК человека
— Но как можно «оперировать» ген, неужели речь идет о реальных технологиях?
— Есть много способов разрезать молекулу ДНК. Инструменты для этого люди позаимствовали у бактерий. Борясь за место под солнцем (или, наоборот, в тени) бактерии синтезируют белки или комплексы белков и РНК, которые разрезают ДНК других видов бактерий и вирусов, но безвредны для ДНК хозяйки и её потомков. Эти молекулы прикрепляются к специфическим последовательностям ДНК (специфической фразе из «букв» А, С, T и G), которых заведомо нет в геноме хозяйки. Так что «отщипнуть» — не проблема, главное – правильно сшить обратно разрезанную молекулу. Если этого не сделать, то произойдёт разрыв хромосомы и нарушение функций того участка, где находится разрыв.
” — Сейчас наиболее перспективным орудием генного инженера считается бактериальная система CRISPR /Cas9 – часть иммунитета бактерий, модификации которой активно используют для редактирования геномов эукариот (живых организмов, клетки которых содержат ядра – прим. ред.). Бактерии «держат про запас» у себя в геноме фрагменты ДНК вирусов, с которыми они сталкивались раньше. Эти фрагменты позволяют бактерии быстро строить конструкции, состоящие из РНК и белков, которые специфически разрезают ДНК вирусов. При этом белок Cas9 функционирует как молекулярные ножницы, а так называемая gРНК, частично содержащая генетическую последовательность вируса, — это система GPS-навигации, которая направляет «ножницы» на специфический район ДНК. Бактерии борются с генами вирусов, но такой биотехнологический инструмент можно нацелить на произвольный участок ДНК любого организма.
— Чтобы клетка, ДНК которой разрезали таким способом, смогла восстановиться, в неё параллельно вводят ДНК с нужной последовательностью. Клетка запускает собственные механизмы починки ДНК и использует добавленную ДНК как матрицу для починки полученного повреждения. Таким образом, можно поменять одну генетическую последовательность на другую!

— Где же берут «правильные» гены?
— Практически любой ген человека можно вставить в геном бактерии, заставить эту бактерию активно делиться, а потом снова выделить нужный фрагмент в большом количестве. Так, сложные животные белки уже давно не выделяют из органов животных, а нарабатывают с помощью встроенных в бактерии генов (например, инсулин).
Может ли генная инженерия подарить здоровье и карие глаза
— То есть, генная инженерия возможна – пусть и в порядке лабораторного эксперимента?
— Чем сложнее организм, тем труднее это сделать. Для получения генномодифицированных лабораторных организмов такие подходы используются уже давно. Область применения этих методов – генная модификация сельхозкультур, сельскохозяйственных животных, но в особенности бактерий.
Однако перенести разработанные для экспериментальных организмов подходы на человека напрямую невозможно. Методы, которыми работают на животных и растениях, недостаточно специфичны. Часть полученных организмов нежизнеспособны, часть имеет «не те» признаки, их просто выбраковывают. Примером может служить «золотой рис». Его выводили методом генной модификации, добавив к геному риса два гена других организмов, что способствовало накоплению бета-каротина в его семенах. Действительно, был получен рис с заданными характеристиками, но его урожайность оказалась снижена. Предполагается, что причина этого – неудачные места встраивания новых генов.
С человеком цена ошибки слишком высока, поэтому эксперименты на людях очень ограничены. Любые генетические перестройки – риск перерождения клетки в раковую или её гибели. Естественно, можно обрабатывать культуру клеток или, например, колонию бактерий, но в итоге стараются выбирать только те клетки, которые имеют определённые характеристики, являющиеся признаком того, что модификация их генома действительно произошла.
” — Если обрабатывать многоклеточный организм, то в части клеток модификация может пройти, а в части нет. Предсказать, какая из клеток станет впоследствии предшественником конкретных тканей организма, невозможно, поэтому эффект такой модификации сейчас непредсказуем. Условно говоря, клетка, куда встроился ген кареглазости, попадёт в итоге в пятку.
— Можно ли поменять весь геном взрослого человека?
— Нет, работать со всеми клетками взрослого человека сейчас невозможно, да и не нужно. Организм, имеющий тяжёлое генетическое нарушение, влияющее на функции каждой клетки, просто погибает пренатально. Совместимые с жизнью генетические нарушения в основном проявляются в каком-то определённом органе или системе органов. Именно они и будут являться мишенями генных инженеров. Если ты хочешь карие глаза, то совершенно необязательно модифицировать ДНК пяток. Отработанных методик таких манипуляций со стабильным предсказуемым результатом на человеке пока нет, но генная инженерия развивается очень быстро, так что ждём!

— Первые опыты по использованию генной инженерии в лечении генетических заболеваний уже есть?
— В литературе описан успешный опыт генной терапии булёзного эпидермолиза (редкое хроническое наследственное заболевание, в результате которого непрерывно образуются раны на коже и слизистых оболочках – прим. ред.). Стволовые клетки кожи пациента обрабатывали вирусоподобными частицами, содержащими нормальную последовательность гена, выведенного из строя мутациями. Полученные клетки заселяли в повреждённые участки кожи ребёнка, и кожные покровы восстанавливались!
Были и попытки влиять на организм взрослого человека. Для этого в оболочку аденовирусной частицы упаковывали нужный генетический материал и с помощью аэрозоля обрабатывали дыхательные пути пациентов. Вирусные частицы прикреплялись к клеткам эпителия и впрыскивали в клетки ДНК «нужного» гена. Проводились и эксперименты по обработке вирусоподобными частицами с «правильными» генами клеток крови пациента.
” — В этих экспериментах результаты тоже были, но нестойкие. Это связано с тем, что изменённые клетки, хоть и производили нужные белки, но не размножались. Постепенно «правильные» клетки умирали, и симптомы заболевания возвращались. Ещё одна проблема такого метода – иммунный ответ организма на эти вирусоподобные частицы. Многие параметры при таком подходе контролировать невозможно, есть угроза повреждения нормального генетического материала клеток.
— Поэтому сейчас наиболее перспективное направление – модификация собственных стволовых клеток человека и запуск их обратно в организм. Уже есть методики забора фибробластов из кожи, перевод их обратно в состояние стволовых клеток и перепрограммирование в некоторые другие типы клеток. Это сейчас фактически остриё науки, на это брошено много сил и финансов (правда, не у нас в стране). Выращенные таким образом генетически «подправленные» клетки могут помочь человеку побороть СПИД и некоторые виды рака.
Пересадка собственных митохондрий недавно была использована у новорождённых с сердечно-сосудистыми патологиями в США. Вместо плохо работающего собственного сердца, с разрушенными от кислородного голодания митохондриями, не стали ставить донорское; в повреждённый участок сердечной мышцы вводили митохондрии, полученные из мышечной ткани детей. Клетки сердца захватили митохондрии и начинали работать нормально. В результате из 11 больных детей восьмерым не потребовалась трансплантация сердца! Хотя такую манипуляцию нельзя назвать генно-инженерной, но она создаёт задел для лечения пациентов, в том числе и «чужими» митохондриями.
Вообще в медицине много надежд возлагается именно на использование собственных немного доработанных клеток, и именно в связи с этим, я думаю, будет пересматриваться законодательство в области генной модификации по отношению к человеку.